Beschäftigt man sich mit Cannabis und dessen Inhaltsstoffen, dann fallen einem Stoffe wie Cannabidiol (abgek. CBD) oder Tetrahydrocannabinol (abgek. THC) als erstes ein. Die meisten wissen nicht, dass diese Substanzen nur in geringen Mengen im Hanf vorkommen. Im Cannabis selber liegen die Endprodukte CBD oder THC nicht vor. Diese werden erst später aus deren Vorstufen gewonnen.
Der kleine Unterschied
Wir wollen einmal unter das Mikroskop schauen und die Cannabidiolsäure und Cannabidiol etwas genauer betrachten. Behaltet dabei im Hinterkopf, dass es bei anderen bekannten Stoffen, wie Tetrahydrocannabinol oder Cannabichromen nicht viel anders abläuft.
Die zwei Typen
Cannabinoide können in zwei Typen unterteilt werden: Neutrale Cannabinoide und Cannabinoidsäuren. So ist das Hauptcannabinoid im Nutzhanf nicht CBD, sondern CBDA (englisch: CBD-Acid) und das Hauptcannabinoid in „THC“-reichen Pflanzen eben nicht THC, sondern THCA ist. Erst durch weitere Bearbeitungsschritte kommt es zur Umwandlung in die neutrale Form [5,6]
Gerade bei Cannabisprodukten, sei es in der Medizin oder zur Selbstmedikation, ist es wichtig zu wissen was im Rohmaterial vorhanden ist und vor allem in welcher Form. Nur so kann bei den über 100 verschiedenen Cannabinoiden, die zum Teil durch die Analysemethoden selbst erschaffen werden, die Komposition bestimmt und für die richtige Anwendung genutzt werden [6].
Der kleine Unterschied?
Wenn wir uns Tetrahydrocannabinol und seine Säureform anschauen, ist ein essentieller Unterschied schnell klar. THC erweitert unser Bewusstsein, THCA nicht. [1]. Leider ist es im Falle von CBD und CBDA nicht so eindeutig. Beide sind kaum psychoaktiv, sodass eine so eindeutige Unterscheidung nicht möglich ist. Trotzdem wurden durch Forschungen in den letzten Jahren viele Gemeinsamkeiten und Unterschiede aufgedeckt.
Kommen wir zu den bekannten gemeinsamen Wirkungen. Beide wirken fördernd auf TRPA1 und TRPM8 Rezeptoren (Bindungsstellen in unserem Körper) und somit schmerzlindernd [9]. CBDA, sowie CBD wirken auf TRPV1- und TRPV2-Rezeptoren und tragen so auch zu einer Schmerzlinderung und antipsychotischen Wirkung bei [6,9,17]. Sie helfen potentiell bei Krebs, wobei die Wirkung der Säure, im Gegensatz zum Neutralen, schwächer ist [9,14]. Dabei steht bei der Cannabidiolsäure die Hemmung von Brutkrebs im Forschungsmittelpunkt [15]. Ebenso haben beide Wirkstoffe einen hemmenden Einfluss auf das Zusammenziehen des Darms, wobei auch hier Cannabidiol die effektivere Variante ist [12]. Ein weiteres gemeinsames Ziel sind die 5HT1a(Serotonin) Rezeptoren. Dort wirken sie nicht fördernd, sondern hemmend. Eine angstlösende Wirkung und Abhilfe bei Durchblutungsstörungen sind die Ergebnisse [9]. Bei Versuchen mit Ratten wurde zudem herausgefunden, dass die Blockierung des oben genannten Serotoninrezeptors Übelkeit und Erbrechen lindert, was eine der momentanen Hauptanwendungen von CBDA ist. Dort wirkt es sogar besser als CBD [10,14,17]. Entzündungshemmende Eigenschaften können auf beiden Seiten verzeichnet werden [9].
Neben diesen Gemeinsamkeiten gibt es auch viele unterschiedliche Effekte. Aus diesen lässt sich schließen, dass das Wirkungsspektrum von CBD in weiten Teilen das von CBDA übersteigt [14]. So werden Cannabidiol unter anderem neuroprotektive Eigenschaften, Verstärkung von Opiaten, [9] und sogar Abhilfe bei Malaria zugesprochen [16].
Aktuelle Gratis-Produkte
-
 CANNABIS BAKEHOUSE - KaffeebohnenProdukt im Angebot
CANNABIS BAKEHOUSE - KaffeebohnenProdukt im Angebot19,50€0,00€ -
 Marry Jane - MJ Pod CartridgeProdukt im Angebot
Marry Jane - MJ Pod CartridgeProdukt im Angebot19,90€0,00€ -
 Marry Jane - MJ PodProdukt im Angebot
Marry Jane - MJ PodProdukt im Angebot29,90€0,00€
Exkursion: Zusammensetzung von Cannabinoiden
In den vorherigen Absätzen ist die Rede von Cannabidiolsäure als Vorstufe von Cannabidiol. Damit man ein grundlegendes Verständnis dafür bekommt, was es mit der Säure auf sich hat und warum diese essentiell ist, werden wir hier ein paar Worte über die Entstehung, auch Biosynthese genannt, der Cannabinoide verlieren. Der Vorgang findet in den Trichomen statt [7].
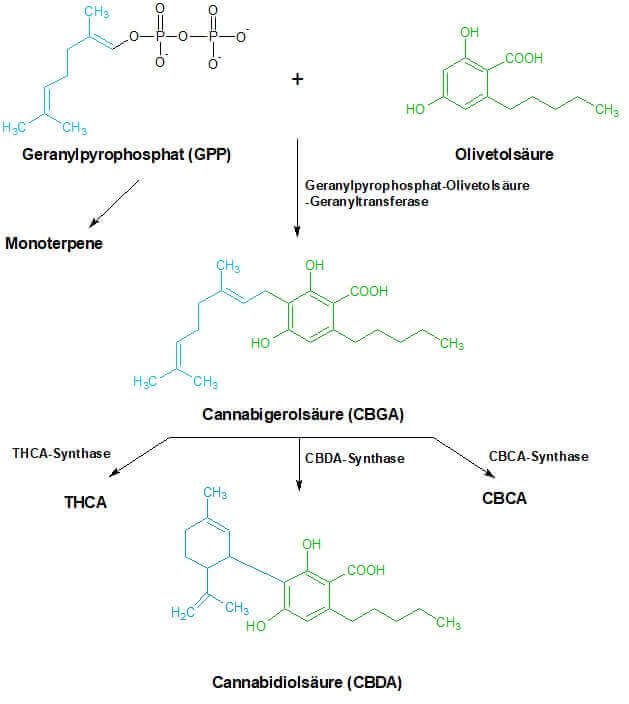
Basis einiger bekannter Cannabinoide sind Olivetolsäure und Geranylpyrophosphat (abgek. GPP). Die Ausgangsverbindung vieler ätherischer Öle (Monoterpene) im Cannabis, wie Limonene oder Pine, GPP. Über eine Reaktion mittels Helferproteinen (Enzyme) entsteht Cannabigerolsäure, die Grundlage für CBDA, CBCA und das bekannte THCA in seiner sauren Gestalt. THCA und CBDA entstehen in Abhängigkeit von Sauerstoff. Als Nebenprodukt wird Wasserstoffperoxid erzeugt. Man kennt diesen Stoff aus Bleichmitteln oder dem Friseursalon, wo es zum Färben, Tönen oder Blondieren genutzt wird [5,6]. Ab diesem Punkt kommt der Mensch, in einem Schritt, der sich in Fachkreisen Decarboxylierung nennt, ins Spiel.
Von der Säure zum Neutralen
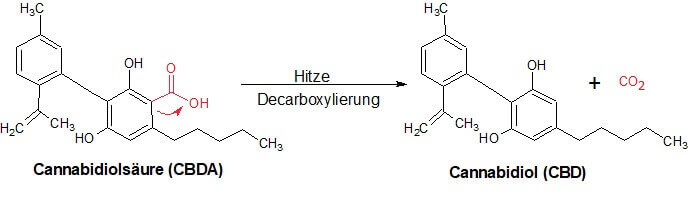
Bei der Decarboxylierung wird aus den Cannabinoiden eine Säure abgespalten, wodurch diese in eine neutrale Form überführt werden.
Bei dem Vorgang sind keine Enzyme mehr eingebunden, wie es noch bei den Vorstufen von CBD der Fall war [1,4,6,8]. Cannabinoidsäuren sind thermisch instabil und können durch Wärme in die neutrale Gestalt umgewandelt werden [1]. Auch in der Industrie wird diese Eigenschaft zur Erschaffung von CBD genutzt. Damit kann man auch den Sinn des Rauchens oder Backens von Blüten selbst erklären.
[su_box title=”Wissenswertes zur Decarboxylierung”]
Allgemein versteht man unter der Decarboxylierung die Abspaltung von Kohlenstoffdioxid (CO2) aus einer Carbonsäure(R-COOH). In unserem Fall ist CBDA die Carbonsäure [3].
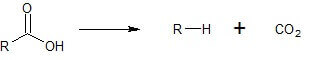 Es handelt sich hier um eine Reaktion der ersten Stufe oder einfacher formuliert um eine Eliminierungsreaktion. Diese Art der Reaktion ist alleine von der Menge der Ausgangsstoffe (hier: CBDA) abhängig [2,4].[/su_box]
Es handelt sich hier um eine Reaktion der ersten Stufe oder einfacher formuliert um eine Eliminierungsreaktion. Diese Art der Reaktion ist alleine von der Menge der Ausgangsstoffe (hier: CBDA) abhängig [2,4].[/su_box]
Studien haben ergeben, dass bei der Decarboxylierung von CBDA, im Gegensatz zu der Umformung von THCA zu THC, Nebenprodukte oder auch Einbußen vorkommen, deren Reaktionen noch nicht identifiziert wurden. So kam es bei der Umwandlung zu einem Gesamtverlust von bis zu 18 Prozent. [2,4].
Auch das neutrale Cannabidiol ist in kleinen Mengen im Hanf vorhanden. Durch äußere Einflüsse wie Hitze und Licht kommt es hier zu einer natürlichen Umwandlung. So kann das Verhältnis zwischen CBD und CBDA, oder auch anderen Cannabinoiden, als ein Rückschluss auf Lagerung und Produktionsprozess dienen [1,4,5,6,8].
[su_box title=”Details zur Decarboxylierung von Cannabinoiden”]
Bei der Decarboxylierung mit Hitze ist es wichtig, Temperatur und Zeit genau abzustimmen. Dabei kann viel schief gehen: Nicht vollständige Umwandlung, Verdampfung oder Abbau der Cannabinoide [13]. Man kann diese Verluste nicht verhindern, nur Kompromisse eingehen. Kurz und knapp haben Forschungen folgendes ergeben:
- Bei 100 Grad Celsius findet eine maximal mögliche Decarboxylierung nach zirka 60 Minuten statt. [13]
- Bei 130 Grad Celsius findet eine maximale mögliche Decarboxylierung nach frühestens 9 und spätestens 15 Minuten statt [2,13]
- Bei 145 Grad Celsius findet eine maximale Decarboxylierung nach frühestens 6 und spätestens 10 Minuten statt.
- Bei 210 Grad Celsius reichen wenige Sekunden.
In der Industrie oder der Forschung wird zum Teil mit speziellen Apparaturen und Methoden gearbeitet. Die Vorgänge laufen unter optimierten Bedingungen, wie das Arbeiten im Vakuum oder mit Lösungsmitteln ab [2]. Was passiert mit Terpenen, Flavonoiden und weitere Stoffen bei der Erhitzung? Um das Thema nicht zu sprengen haben wir diese außer Acht gelassen. Auch hier kommt es zu Reaktionen bei der Erhitzung.[/su_box]
Die Quintessenz
CBDA und nicht CBD ist der dominierende Stoff im unbehandelten Nutzhanf. Sie ist das Endprodukt der Biosynthese. Erst Hitze, aber auch Licht, decarboxylieren CBDA in die neutrale Form. Dabei kommt es jedoch zu unvermeidlichen Verlusten. Cannabidiol und die Vorstufen haben sowohl Unterschiede als auch Gemeinsamkeiten.
Zu guter Letzt
Betrachtet man das Gros der frei verfügbaren Cannabisextrakte, so fällt auf, dass viele CBD enthalten. Je nach Anwendungsgebiet sollte überlegt werden, ob dies notwendig ist. Reicht es aus, CBDA anstelle von CBD zu verwenden? In diesem Kontext sind weitere Forschungen zum Thema Cannabidiolsäure wünschenswert und, bei der im Augenblick boomenden Cannabisforschung, nur eine Frage der Zeit.
Quellen
Wang, M., Wang, Y. H., Avula, B., Radwan, M. M., Wanas, A. S., Van Antwerp, J., Khan, I. A. (2016). Decarboxylation Study of Acidic Cannabinoids: A Novel Approach Using Ultra-High-Performance Supercritical Fluid Chromatography/Photodiode Array-Mass Spectrometry. Cannabis and Cannabinoid Research, 1(1), 262-271. [2] Dussy, F. E., Hamberg, C., Luginbühl, M., Schwerzmann, T., & Briellmann, T. A. (2004). Isolation of D9 -THCA-A from hemp and analytical aspects concerning the determination of D9 -THC in cannabis products. Abgerufen von https://www.sciencedirect.com/science/article/pii/S0379073804003408 [3] Breitmaier, E., & Jung, G. (2005). Organische Chemie: Grundlagen, Stoffklassen, Reaktionen, Konzepte, Molekülstruktur (5. Aufl.). Darmstadt, Deutschland: Thieme/KNO VA. [4] Citti, C., Pacchetti, B., Vandelli, M. A., Forni, F., & Cannazza, G. (2017). Analysis of cannabinoids in commercial hemp seed oil and decarboxylation kinetics studies of cannabidiolic acid (CBDA). Abgerufen von https://www.ncbi.nlm.nih.gov/pubmed/29182999 [5] Sirikantaramas, S., & Taura, F. (2017). Cannabinoids: Biosynthesis and Biotechnological Applications. In S. Chandra, H. Lata, & M. A. ElSohly (Hrsg.), Cannabis sativa L. – Botany and Biotechnology (S. 183-206). Berlin, Deutschland: Springer. [6] Degenhardt, F., Stehle, F., & Kayser, O. (2017). Chapter 2 – The Biosynthesis of Cannabinoids. In V. R. Preedy (Hrsg.), Handbook of Cannabis and Related Pathologies – Biology, Pharmacology, Diagnosis, and Treatment (S. 12-23). Amsterdam, Niederlande: Elservier. [7] Gagne, S. J., Stout, J. M., Boubakir, Z., Clark, S. M., & Page, J. E. (2012). https://www.ncbi.nlm.nih.gov/pubmed/22802619. Abgerufen von https://www.ncbi.nlm.nih.gov/pubmed/22802619 [8]Chrombie, L., Ponsford, R., Shani, A., Yagnitinsky, B., & Mechoulam, R. (1968). Hashish components. Photochemical production of cannabicyclol from cannabichromene.. Abgerufen von https://www.ncbi.nlm.nih.gov/pubmed/5697175 [9] Izzo,A.A.,Capasso,R., Di Marzo, V., & Mechoulam, R. (2009). https://www.ncbi.nlm.nih.gov/pubmed/19729208. Abgerufen von https://www.ncbi.nlm.nih.gov/pubmed/19729208 [10] Bolognini, D., Rock, E. M., Rock, N. L., Cascio, M. G., Limebeer, C. L., Duncan, M., Pertwee, R. G. (2013). Cannabidiolic acid prevents vomiting in Suncus murinus and nausea-induced behaviour in rats by enhancing 5-HT1A receptor activation. Abgerufen von https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3596650/ [11] McPartland, J. M., MacDonald, C., Young, M., Philip, G. S., Furkert, D. P., & Glass, M. (2017). Affinity and Efficacy Studies of Tetrahydrocannabinolic Acid A at Cannabinoid Receptor Types One and Two. Cannabis and Cannabinoid Research, 2(1), 87-95. [12] Cluny, N. L., Naylor, R. J., Whittle, B. A., & Javid, F. A. (2011). The effects of cannabidiolic acid and cannabidiol on contractility of the gastrointestinal tract of Suncus murinus. Abgerufen von https://link.springer.com/article/10.1007%2Fs12272-011-0913-6 Grotenhermen, F., & Häußermann, K. (2017). Cannabis: Verordnungshilfe für Ärzte. Stuttgart, Deutschland: Wissenschaftliche Verlagsgesellschaft. [14] Grotenhermen, F., Berger, M., & Gebhardt, K. (2015). Cannabidiol (CBD): Ein cannabishaltiges Compendium. Solingen, Schweiz: Nachtschatten Verlag. [15] Takeda, S., Okajima, S., Miyoshi, H., Yoshida, K., Okamoto, Y., Okada, T., . . . Aramaki, H. (2012). Cannabidiolic acid, a major cannabinoid in fiber-type cannabis, is an inhibitor of MDA-MB-231 breast cancer cell migration. Abgerufen von https://www.sciencedirect.com/science/article/pii/S0378427412012854 [16] Campos, A. C., Brant, F., Miranda, A. S., Machado, F. S., & Teixeira, A. L. (2015). Cannabidiol increases survival and promotes rescue of cognitive function in a murine model of cerebral malaria. Neuroscience, 289, 166-180. [17] [17] Shbiro, L., Hen-Shoval, D., Hazut, N., Zalsman, G., Mechoulam, R., Wellter, A., & Shoval, G. (2017). Anti-depressant-like effects of cannabidiol and cannabidiolic acid in genetic rat models of depression. Abgerufen von http://www.europeanneuropsychopharmacology.com/article/S0924-977X(17)31426-8/




